Penentuan Tetapan Laju Reaksi Penyabunan Etil Asetat
Pendahuluan
Reaksi penyabunan atau saponifikasi adalah proses hidrolisis basa kuat
seperti KOH dan NaOH terhadap lemak (lipid). Dimana reaksinya akan menghasilkan
gliserol sebagai hasil sampingan. Dengan reaksi sebagai berikut:
C3H5(OOCR)3 + 3
NaOH → C3H5(OH)3 +
3 NaOOCR
Gliserol Na-Stearat (sabun)
(Purba, 2006)
Menurut Keenan (1980), sabun bertindak sebagai suatu zat pengemulsi untuk
mendispersikan minyak dan sabun teradsorpsi pada butiran kotoran.
Kinetika kimia merupakan bagian dari ilmu kimia fisika yang mempelajari
tentang kecepatan ataupun laju reaksi-reaksi kimia dan mekanisme reaksi-reaksi
yang terlibat didalamnya. Kecepatan reaksi atau laju reaksi adalah kecepatan
perubahan konsentrasi terhadap waktu, jadi tanda negatif hanya menunjukkan
bahwa konsentrasi berkurang bila waktu bertambah. (Sukardjo, 2002).
Laju reaksi dapat pula digunakan untuk memprediksi kebutuhan bahan pereaksi
tiap satuan waktu dan dapat juga digunakan untuk menghitung kebutuhan energi
untuk produksi hydrogen (Wibowo,
2010). Seiring bertambahnya waktu dalam suatu reaksi, mka jumlah zat pereaksi
akan menjadi produk, dan sebaliknya jumlah zat hasil reaksi(produk) akan
semakin bertambah. Satuan laju reaksi adalah mol/L det atau M det-1.
Menurut Setiaji (2011), faktor-faktor yang mempengaruhi laju reaksi adalah : 1)
Temperatur , semakin tinggi suhu dalam sistem maka reaksi dalam sistem akan
semakin cepat pula, 2) Katalis, keberadaan katalis dalam suatu reakasi ini akan
memperepat jalannya suatu reaksi dalam sistem tanpa merubah komposisi, 3)
Konsentrasi reaktan, semakin tinggi konsentrasi reaktan maka semakin cepat
reaksi yang terjadi, 4) Tekanan, tekanan yang dimaksud adalah tekanan gas,
semakin tinggi tekanan reaktan maka reaksi akan semakin cepat berlangsung, 5)
Luas permukaan, semakin luas permukaan suatu partikel maka reaksi akan semakin
cepat berlangsung.
Selain penentuan laju reaksi, percobaan juga dapat menunjukkan orde suatu
reaksi. Orde reaksi merupakan jumlah pangkat dari faktor konsentrasi dalam
hukum laju bentuk deferensial. Umumnya orde reaksi terhadap suatu zat tidak
sama dengan koefisien dalam persamaan stoikiometri reaksi (Hiskia, 2003).
Reaksi yang terjadi pada penyabunan etil asetat merupakan salah satu reaksi
berorde dua, meskipun reaksi yang terjadi pada penyabunan etil asetat bukan
reaksi sederhana. Sehingga hukum hukum laju reaksi untuk penyabunan etil asetat
dapat dinyatakan sebagai:
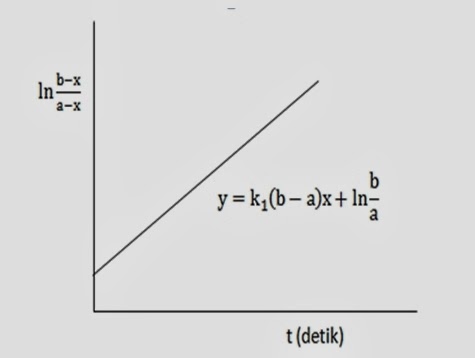
dimana:
a : konsentrasi awal ester dalam mol/liter
b : konsentrasi awal ion OH‾ dalam mol/liter
x : jumlah
mol/liter ester atau basa yang telah bereaksi pada waktu t
Apabila
dialurkan terhadap
waktu (t) akan diperoleh garis lurus dengan arah lereng
, sehingga dari arah lereng ini memungkinkan perhitungan
dari tetapan reaksi
. Hubungan tersebut dapat dilihat pada gambar 1 (Wahyuni,
2013).
Gambar 1. Plot
terhadap t
Dalam
praktikum ini akan menyelesaikan apa bukti bahwa penyabunan etil asetat oleh
ion hidroksida adalah reaksi orde dua dan berapa tetapan laju reaksi pada
penyabunan etil asetat. Tujuan dari praktikum ini adalah membuktikan bahwa
reaksi penyabunan etil asetat oleh ion hidroksida adalah reaksi yang berorde
dua dan menentukan tetapan laju reaksi yang terjadi pada saponifikasi etil
asetat.
Metode
Pada praktikum penetapan penyabunan etil asetat ini menggunakan alat-alat sebagai
berikut: seperangkat alat titrasi yang berupa buret 50 mL lengkap dengan statif
dan klem, labu ukur 100 mL dan 250 mL dari pyrex,
pipet volum 10 mL dari pyrex, pipet
ukur 1 mL, 5 mL, dan 25 mL dari pyrex,
erlenmeyer 100 mL dan 250 mL dari pyrex,
corong kaca, pipet tetes, serta stopwatch.
Sedangkan untuk bahan-bahan yang digunakan dalam praktikum ini adalah HCl p.a produksi dari Merckproduksi dari
Merck, etil asetat p.a, NaOH for syn produksi dari Merck, indikator
pp(phenol-ptialin), aquades serta
alkohol.
Langkah awal yang dilakukan pada praktikum penetapan laju reaksi penyabunan
etil asetat adalah alat-alat dan bahan-bahan yang akan digunakan disiapkan.
Langkah selanjutnya larutan NaOH 0,10256 M dibuat dengan cara melarutkan 1,0256
gram kristal NaOH dalam aquades hingga volume menjadi 250 mL.
Langkah
berikutnya yaitu dengan membuat larutan
etil asetat 0,1 M yaitu dengan cara larutan etil asetat p.a sebanyak 0,98 mL diencerkan menjadi 100 mL. Untuk membuat
larutan HCl 0,1 M juga sama seperti membuat larutan lainnyan, yaitu dengan diencerkannya
larutan HCl p.a sebanyak 2,07 mL
menjadi 250 mL larutan. Kemudian, larutan 0,10256 M larutan NaOH sebanyak 50 mL
dan 0,1 M larutan etil asetat sebanyak 50 mL didiamkan hingga mencapai
temperatur termostat. Untuk langkah selanjutnya larutan HCl 0,1 M dibagi kedalam
8 erlenmeyer (masing-masing erlenmeyer sebanyak 20 mL), langkah selanjutnya
larutan etil asetat dan NaOH yang telah termostat dicampur dengan cepat. Pada
menit ke-0, 3, 8, 15, 25, 40, dan 65 campuran diambil(dicuplik) sebanyak 10 mL,
selanjutnya cuplikan tersebut dimasukkan kedalam erlenmeyer yang telah diisi
dengan larutan HCl 0,1 M. Langkah selanjutnya, yaitu campuran larutan pada
menit ke-0, 3, 8, 15, 25, 40, dan 65 yang bereaksi dengan HCl 0,1 M diambil
lagi 10 mL dan kemudian dititrasi, titrasi dilakukan secara duplo. Titrasi
dilakukan dengan larutan NaOH 0,10256 M hingga terbentuk warna merah muda yang
tak hilang.
Variabel terikat pada praktikum ini adalah laju reaksi penyabunan etil
asetat. Sedangkan variabel bebas pada praktikum ini adalah konsentrasi reaktan
(konsentrasi etil asetat dan konsentrasi NaOH). Untuk temperatur, tekanan, dan
metode praktikum sebagai variabel kontrol.
Data yang diperoleh berupa berupa volum NaOH yang dibutuhkan untuk
menetralkan HCl sisa reaksi dengan campuran NaOH-etil asetat pada menit
tertentu. Dari persamaan laju,
pada tetapa laju reaksi penyabunan etil asetat oleh ion
hidroksida dapat diperoleh hubungan antara
terhadap t, kurva
linear yang diperoleh dari hubungan tersebut inilah menunjukkan reaksi orde
dua.
Hasil dan pembahasan
Penentuan laju reaksi etil asetat dapat dilakukan dengan metode titrasi
atau konduktometri. Namun pada praktikum kali ini metode yang digunakan adalah
titrimetri atau metode titrasi. Penyabunan etil asetat terjadi antara etil
asetat dan NaOH dalam waktu tertentu dan dalam keadaan yang termostat. Keadaan
termostat ini harus dilakukan karena temperatur merupakan salah satu hal yang
mempengaruhi laju reaksi. Jika suhu dinaikkan maka laju reaksi akan semakin
cepat, karena kalor yang diberikan akan menambah energi kinetik partikel
pereaksi, akibatnya tumbukan antar partikel akan bertambah besar, dan
sebaliknya.
Kemudian campuran etil asetat dan NaOH yang telah termostat ditambahkan
HCl, tujuannya adalah untuk mengetahui banyaknya NaOH yang tersisa dalam proses
saponifikasi tersebut serta memberikan suasana asam. Karena hasil awal dari
reaksi saponifikasi adalah karboksilat. Sehingga penambahan HCl ini mengubah
karboksilat menjadi asam karboksilat. Reaksinya dapat dilahat sebagai berikut:
CH3COOC2H5 + OH‾ → CH3COO‾ + C2H5 OH + NaOH sisa
reaksi
NaOH sisa reaksi + 2 HCl → NaCl + H2O +
HCl sisa
Selanjutnya larutan tersebut ditambah dengan PP untuk selanjutnya dititrasi
dengan NaOH. Penambahan indikator PP bertujuan untuk mengetahui titik akhir
titrasi yaitu titik dimana mol NaOH sama dengan mol HCl yang ditandai dengan
perubahan warna larutan dari tak berwarna menjadi merah muda yang tak hilang.
HCl sisa + NaOH → NaCl + H2O
Dalam praktikum ini diperoleh volum yang diperlukan untuk menitrasi menjadi
semakin bertambah seiring bertambahnya waktu saat terjadinya penyabunan
(saponifikasi) etil asetat. Data volume NaOH 0,010256 M yang diperlukan untuk
menitrasi sisa asam pada penyabunan etil asetat dapat dilihat pada tabel 1.
Tabel 1. Volum NaOH 0,010256 M
yang diperlukan untuk titrasi pada t tertentu
Jenis titer
|
Volume NaOH yang
diperlukan (mL)
|
V rata-rata
|
|
V1
|
V2
|
||
HCl blanko
|
7,00
|
7,00
|
7,00
|
campuran menit ke-0
|
5,30
|
5,35
|
5,325
|
Campuran menit ke-3
|
5,65
|
5,60
|
5,625
|
Campuran menit ke-8
|
5,90
|
5,90
|
5,90
|
Campuran menit
ke-15
|
6,25
|
6,30
|
6,275
|
Campuran menit
ke-25
|
6,50
|
6,45
|
6,475
|
Campuran menit
ke-40
|
6,65
|
6,70
|
6,675
|
Campuran menit
ke-65
|
6,80
|
6,75
|
6,775
|
Pada tabel 1 menunjukkan volum yang digunakan untu menitrasi 10 mL cuplikan
yang diambil dari 30 mL dari larutan campuran dari larutan HCl 20 mL dan
larutan etil asetat-NaOH 20 mL (pada t tertentu). Data pada tabel 1 harus
diubah sehingga dapat dinyatakan dalam jumlah yang setara untuk campuran awal,
yaitu 100 mL.
Jumlah mol NaOH awal telah diketahui, maka jumlah mol NaOH yang bereaksi
dengan etil asetatpun dapat diketahui. Data yang digunakan dalam analisis ini
adalah dalam bentuk konsentrasi yang dinyatakan dalam satuan mol/L. Oleh karena
itu volum data yang diperoleh dari praktikum (pada tabel 1) harus diubah
menjadi molaritas yaitu dengan membagi jumlah mol NaOH yang bereaksi pada t
tertentu pada proses penyabunan etil asetat. Dapat dilihat pada tabel 2 ini
merupakan konsentrasi NaOH yang telah bereaksi dengan etil-asetat.
Tabel 2. Konsentrasi NaOH yang
bereaksi pada t tertentu
Waktu (menit ke-)
|
[NaOH] yang bereaksi (M)
|
0
|
0,0000
|
3
|
0,008974
|
8
|
0,0174352
|
15
|
0,0289737
|
25
|
0,0351268
|
40
|
0,0412804
|
65
|
0,0443572
|
Perlu kita ketahui bahwa jumlah mol NaOH yang diperlukan untuk titrasi
harus sebanding dengan jumlah mol HCl sisa reaksi. Sisa HCl yang tidak bereaksi
dengan NaOH (dari larutan induk) akan bereaksi dengan NaOH saat dilakukan
titrasi. Semakin lama waktu yang diperlukan untuk pencampuran NaOH dan etil
asetat maka HCl yang sisa semakin banyak, sehingga saat dititrasi diperlukan
NaOH lebih banyak untuk bereaksi dengan HCl sisa tersebut.
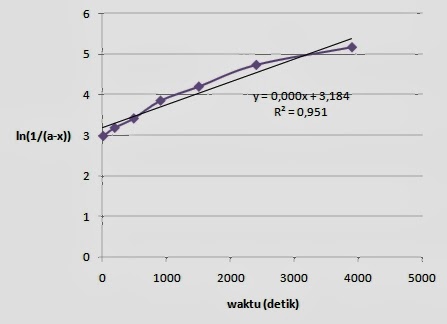
Hubungan antara
terhadap waktu
pencampuran NaOH dengan etil asetat dapat dilihat pada gambar 2 dengan gradien
. Konsentrasi dari NaOH yang bereaksi dengan etil asetat
diperoleh dari hasil pengurangan konsentrasi NaOH mula-mula dengan konsentrasi
etil asetat yang bereaksi. Seperti yang kita ketahui bahwa
, maka dengan mengalurkan plot
dapat diketahui.
Gambar 2. Grafik hubungan antara
terhadap waktu
pencampuran NaOH dengan etil asetat
Dari
gambar diatas dapat diketahui R2 nya sebesar 0,990, dengan gradien
4.10-5. Dari data tersebut dapat kita ketahui harga tetapan laju
reaksi dari penyabunan etil asetat sebesar 0,03125. Data tersebut dapat
menunjukkan bahwa kurva yang diperoleh kurang linear. Hal tersebut kurang tepat
karena mungkin terjadi kesalahan dalam melakukan praktikum. Kesalahan yang
terjadi mungkin disebabkan kurang teliti dalam pembacaan skala nonius, alat yang digunakan kurang
steril, mugkin juga alat yang digunakan rusak.
Pada
reaksi penyabunan etil asetat yang telah dilakukan dalam percobaan ini
diperoleh harga tetapan laju reaksi penyabunan etil asetat (k) sebesar 0,03125.
Dari persamaan
, maka dapat diketahui laju reaksi dari penyabunan etil
asetat. Laju reaksi tersebut dapat dilihat pada tabel 3 sebagai berikut:
Waktu (detik)
|
Laju reaksi
|
0
|
8,0938.10-5
|
180
|
5,4238.10-5
|
480
|
5,4442.10-5
|
900
|
1,4657.10-5
|
1500
|
7,5078.10-6
|
2400
|
2,7247.10-6
|
3900
|
1,2207.10-6
|
Laju
reaksi pada penyabunan etil asetat berbanding terbalik dengan waktu. Pada t=0
laju reaksi pada penyabunan etil asetat berlangsung sangat besar, seiring
berjalannya waktu laju reaksi yang terjadi semakin kecil dalam praktikum ini
laju reaksi yang terjadi hampir mendekati nol.
Pada
penentuan orde reaksi penyabunan etil asetat, digunakan kurva untuk membuktikan
orde reaksi yang terjadi. Kurva yang digunakan pada penentuan orde reaksi
adalah kurva yang menunjukkan linearitas yang terbesar. Dapat dilihat pada
gambar 3, bahwa pada kurva pembuktian orde satu diperoleh dengan mengalurkan
ln(a-x) sebagai fungsi waktu.
Pembuktian
orde dua dapat dilihat pada gambar 4, pembuktian orde dua ini diperoleh dengan
mengalurkan
sebagai fungsi dari
waktu. Selanjutnya, untuk pembuktian orde tiga diperloleh dengan mengalurkan
sebagai ungsi dari waktu seperti yang
disakjikan pada gambar 5.
Gambar 4. Pembuktian reaksi orde dua
Gambar 5. Pembuktian reaksi orde tiga
Dari
ketiga kurva yang disajikan dapat dilihat bahwa pada gambar 4, kurva
menunjukkan linearitas paling tinggi. Hal ini membuktikan bahwa pada reaksi
penyabunan etil asetat merupakan reaksi pada orde dua.
Kesimpulan
Dari hasil praktikum dapat
disimpulkan bahwa reaksi penyabunan etil asetat adalah reaksi yang berorde dua.
Hal ini dibuktikan pada kurva yang diperoleh dari kurva reaksi sebagai fungsi
waktu dan diperoleh harga tetapan laju reaksi dari penyabunan etil asetat
sebesar 0,03125.
Daftar pustaka
Hiskia, Achmad. 2001. Elektrokimia Dan Kinetika Kimia.
Bandung: Citra Aditya Sakti.
Keenan, C.W,dkk. 1990. Kimia Untuk Universitas. Jakarta:
Erlangga.
Purba, Michael. 2006. Kimia Untuk SMA Kelas XII. Jakarta:
Erlangga
Setiadji, Kartiko. 2011. Laporan Percobaan Kimia. Yogyakarta: SMA
1 Jetis.
Sukardjo. 2002. Kimia Fisika. Yogyakarta: Rineka Cipta.
Wahyuni, Sri. 2013. Diktat Petunjuk Praktikum Kimia Fisika.
Semarang: Jurusan Kimia FMIPA UNNES.
Wibowo, Agus. 2010. Laju Reaksi Pencampuran Minyak Jarak dan Air
Pada Hydrogen Reformer Menggunakan Pemanas dan Katalis. Prosiding Seminar
Nasional Sains dan Teknologi 2010. Semarang: FT UNWAHAS Semarang.




Tidak ada komentar:
Posting Komentar